INTRODUCCIÓN
En este post hablaremos acerca de los estados de agregación junto con todos los aspectos que rodean a estos como lo es la temperatura, presión, volumen y cantidad de gas que se ven manifestados en las leyes de Boyle, Charles y Gases Ideales como es la relación entre todos estos. Ademas se desarrollaran algunos ejercicios de cada una de estas leyes.
OBJETIVOS
- Reconocer toso los estados de agregación.
- Identificar la diferencia entre volumen, presión y cantidad de gas.
- Conocer y diferenciar cada una de las leyes de Boyle, Charles y Gases Ideales.
PROCEDIMIENTO
Para realizar el laboratorio virtual sobre la ley de boyle, charles y gases ideales entramos a la siguiente pagina http://www.educaplus.org/gases/ejer_gas_ideal.html que al entrar se ve de de esta manera.
Para desarrollar este laboratorio debemos entrar a conceptos, leyes y por ultimo a ejercicios como podemos ver en el siguiente vídeo.
MARCO TEÓRICO
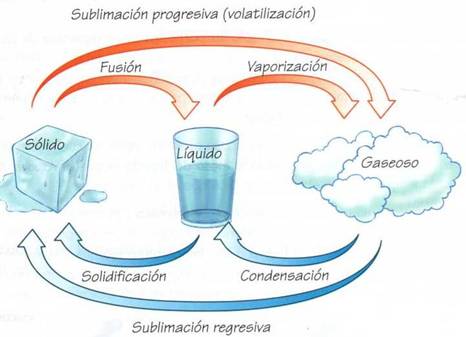
- Estados de Agregación
Cualquier sustancia dependiendo de las condiciones de presión y temperatura a la que esta sea sometida, puede tener diferentes fases conocidas como estados de agregación de la materia que se relacionan con las fuerzas de unión de las moléculas que constituyen la materia. Los estados de agregación son:
- Solido: El esado sólido se caracteriza por tener una forma y volumen constantes esto se debe a que los átomos o moléculas están unidas por una fuerza de atracción por lo cual ocupan posiciones fijas. Las partículas es este estado solo pueden hacer un movimiento vibratorio a través de estas posiciones con una capacidad de movimiento limitada.
- Liquido: El estado líquido al igual que los sólidos poseen un volumen constante pero la fuerza de atracción que mantiene unidas a las moléculas es menor que en los sólidos; gracias a esto sus partículas se pueden mover mas libremente pero aun así este movimiento se ve limitado por las otras moléculas que tienen alrededor. El numero de partículas por volumen en el solido es muy alto esto genera fricciones entre ellas esto explica que lo sólidos no tengan una forma fija y adapten la forma del recipiente que los contiene.
- Gaseoso: Los gases no tienen forma fija y son fluidos al igual que los líquidos pero a diferencian de estos no tienen un volumen fijo. En un gas las moléculas se encuentran muy lejanas unas de otras ya que la fuerza de atracción entre estas es mínima y se mueven en todas direcciones con libertad absoluta.
El movimiento de las partículas de estos estados de agregación según su temperatura, volumen o presión lo podemos ver en el siguiente vídeo.
- Temperatura
En la actualidad hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF).
- Celcius (°C): Es la unidad termométrica cuyo 0 se ubica 0,01 grados por debajo del punto triple del agua que es cuando se encuentran en equilibrio el estado liquido, solido y gaseoso en una sustancia y su intensidad calórica equivale a la del kelvin.
- Kelvin (°K): Es la unidad fundamental de la temperatura; es la escala de temperatura absoluta. El término temperatura absoluta significa que el cero en la escala Kelvin, denotado 0 °K, es la temperatura teórica mas baja que puede obtenerse.
- Fahrenheit (°F): es una escala de temperatura propuesta por Daniel Gabriel Fahrenheit en 1724 esta escala establece como las temperaturas de congelación y ebullición del agua, 32 °F y 212 °F.
Punto de fusión y ebullición del agua..
*Fusión: La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
- Celsius: 0
- Kelvin: 273.15
- Fahrenheit: 32
Los valores otorgados a este punto en cada escala son:
- Celsius: 100
- Kelvin: 373.15
- Fahrenheit: 212
- Presión
P=FS
Como la unidad de medida de la fuerza en el newton (N) y la de la superficie es el metro cuadrado (m²) la unidad de la presion seria (N/m²) llamada pascal (Pa).
1Pa=1Nm2
Existen otras unidades para medir la presión como lo es la atmósfera (atm) y el milímetro de mercurio (mmHg).
*Atmosfera (atm): Es una unidad de medida cualitativa que se define como la presión que ejerce la atmósfera terrestre a nivel del mar. Una atmósfera es equivalente a 101325 Pa (pascales) y es frecuente que 1 atm se refiera como el valor de presión general.
*Milimetro de Mercurio (mmHg): Representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura.
- Volumen
El volumen corresponde a la medida del espacio que ocupa un cuerpo. Los gases ocupan el volumen total del recipiente que los contiene por lo tanto si el volumen del recipiente disminuye esto es equivalente a decir que el volumen del gas también lo ha hecho. Hay muchas unidades para medir el volumen pero las principales son el litro (L) y mililitro (mL).
Equivalencia: 1L = 1000 mL= 1000 cm³
- Cantidad de Gas
La cantidad de gas se refiere al numero de moléculas que hay en un recipiente. La cantidad de gas es expresada en mol.
LEYES: Boyle-Charles-Gases Ideales
- Ley de Boyle
Otra manera diferente de expresar la ley de Boyle a la que aparece en el video es:
- Ley de Charles
La ley de charles habla de la relación entre la temperatura y el volumen de un gas cuando la presión es constante; según Jack Charles cuando se aumenta la temperatura de un gas el volumen también lo hace mientras que si la temperatura disminuía el volumen del gas también disminuye. Esto se debe a que cuando aumentamos la temperatura de un gas las moléculas se mueven con más rapidez y tardan menos tiempo en chocar con las paredes del recipiente.
Otra formula para resolver la Ley de Charles es:
- Gases Ideales
Es la combinación de todas las leyes en una sola ecuación donde R es una constante.
Solución 1
P1·V1 = P2·V2
V1P1= P2.V2
2845 mLP1= 3,54
atm * 5186 mL
P1= 6,452 atm
Solución 2
P1·V1 = P2·V2
P1V1= P2.V2
1,393 atmV1= 0,372
atm * 6047 mL
V1=1614,848 mL
1614,848
mL* 1L =
1,614 L
1000 mL
- Ejercicios Ley de Charles
Solución 1
|
V1
|
|
V2
|
|
-----
|
=
|
-----
|
|
T1
|
|
T2
|
V1*T2 =V2*T1
T2V1= V2.T1
343,4 °KV1= 1,03
mL * 876,8 °K
V1 = 2,63 mL
1030 mL * 1L = 1,03 L
1000 mL
Solución 2
|
V1
|
|
V2
|
|
-----
|
=
|
-----
|
|
T1
|
|
T2
|
V1*T2 =V2*T1
V2T1= V1.T2
T1= 3,41
L * 2170,7 °K
8,33 L
T1 = 888,6 °K
888,6 °K –
273,15 = 615,45 °C
- Ejercicios Gases Ideales
Solución 1
P.V = n.R.T
n*RT= P
* V
0,49 mol * 0,082 atm L
T= 1,21 atm * 8,87 L
T= 1,21 atm * 8,87 L
mol °K
T= 268,3 °K
2870 mL * 1L = 2,87 L
1000 mL
Solución 2
P.V = n.R.T
n*Rn= P * V
0,082 atm L * 160,98 °kn= 1,26 atm * 9 L
mol °K
n= 0,85 moles
















BUEN TRABAJO 5.0
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrar